La nuova versione di Eudravigilance è attiva. Gli operatori sanitari o il singolo cittadino ora può segnalare online tutte le reazioni avverse del farmaco assunto. Sia segnalazione diretta o per conto di un'altro cittadino che abbia sviluppato reazioni avverse da assunzione di farmaco.
AIFA: L'Agenzia Europea dei Medicinali (#EMA) ha lanciato lo scorso 22 novembre, la nuova versione di #EudraVigilance, la piattaforma europea per la segnalazione delle sospette reazioni avverse ai medicinali autorizzati o in fase di sperimentazione clinica nell’UE. L'Agenzia Italiana del Farmaco ha apportato di conseguenza importanti modifiche alla Rete Nazionale di #Farmacovigilanza (RNF) per renderla compatibile ai requisiti del nuovo sistema europeo.
Con l'entrata in vigore della nuova release di Eudravigilance, terminano da oggi le disposizioni transitorie previste dall’art 45 del DM 30/04/2017 commi 4 e 5. Pertanto, i titolari di AIC non saranno più tenuti ad inviare le segnalazioni di sospette reazioni avverse alle autorità nazionali competenti o ai Responsabili di farmacovigilanza (FV) locali delle strutture sanitarie di appartenenza del segnalatore, ma dovranno trasmetterle direttamente ad EudraVigilance che le reindirizzerà in automatico alle autorità nazionali competenti.
Le modifiche alla #RNF sono state lanciate in contemporanea con la messa in produzione della nuova versione di Eudravigilance.
IMPORTANTE
Rimane comunque invariata la segnalazione delle sospette reazioni avverse da parte dei pazienti e degli operatori sanitari che potranno continuare ad inviare le segnalazioni di sospetta reazione avversa secondo le consuete modalità: ai Responsabili di FV della struttura sanitaria di appartenenza, al sistema di segnalazione on-line (#Vigifarmaco) o alle aziende farmaceutiche titolari di AIC.
L’AIFA intende richiamare l'attenzione di tutte le parti coinvolte nel sistema di farmacovigilanza sull'importanza di verificare la qualità, la completezza e l’integrità delle informazioni riportate nelle segnalazioni di sospette reazioni avverse da registrare nei database regolatori (RNF/EV).
Nella settimana di campagna social europea sulla segnalazione degli effetti indesiderati ai medicinali, l’Agenzia ricorda inoltre il valore che ciascuna segnalazione rappresenta a garanzia della sicurezza dei farmaci e a beneficio della salute di tutti.
COSA PUOI FARE DA CITTADINO O MEDICO
1. Gli studi clinici
Prima di essere commercializzato un medicinale è sottoposto a studi preclinici (eseguiti in vitro o su animali di laboratorio) e a studi clinici (eseguiti sull'uomo) Questi studi hanno lo scopo di valutare l'efficacia e la sicurezza del medicinale.
2. Le reazioni avverse
Tuttavia gli studi pre-commercializzazione coinvolgono un numero ridotto di pazienti (es. escludono i bambini e gli anziani) ad hanno una durata relativamente breve, inferiore ai due anni. Inoltre non tengono in considerazione pazienti con patologie concomitanti e/o sottoposti all'uso di più farmaci. Capita, pertanto, che nuovi farmaci vengano ritirati dal commercio in seguito alla successiva identificazione di reazioni avverse.
3. La segnalazione spontanea
Il metodo principale per l'individuazione di reazione avverse causate dai medicinali sul mercato è quello della "segnalazione spontanea". Si tratta di un sistema attraverso cui operatori sanitari, pazienti e industrie farmaceutiche possono inviare in modo volontario segnalazioni di sospette reazioni avverse da farmaci all'autorità regolatrice(ovvero all'Agenzia Italiana del Farmaco).
Puoi fare la tua segnalazione direttamente dal link Vigifarmaco
https://www.vigifarmaco.it
Ultimi Articoli

Strapazzami di coccole Topo Gigio il Musical: una fiaba che parla al cuore

Goldoni al Teatro San Babila di Milano con La Locandiera

Ceresio in Giallo chiude con 637 opere: giallo, thriller e noir dall'Italia all'estero

Milano celebra Leonardo — al Castello Sforzesco tre iniziative speciali per le Olimpiadi 2026

Trasporto ferroviario lombardo: 780.000 corse e 205 milioni di passeggeri nel 2025

Piazza Missori accoglie la Tenda Gialla – Tre giorni di volontariato under zero con i Ministri di Scientology

Neve in pianura tra venerdì 23 e domenica 25 gennaio — cosa è realmente atteso al Nord Italia

Se ne va Valentino, l'ultimo imperatore della moda mondiale
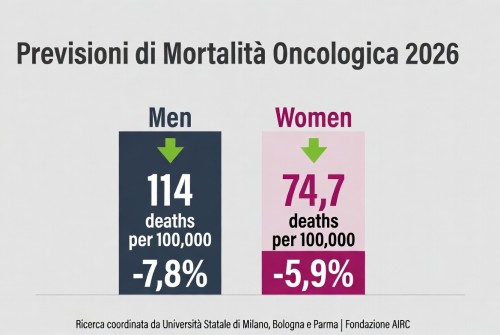
La mortalità per cancro cala in Europa – tassi in diminuzione nel 2026, ma persistono disparità



